Medikal Cihazlara ve IVD ürünlere 510(k) Başvurusunu Nasıl Yapıyoruz
Bir çok firma Amerika pazarına girmenin zor olduğunu ya da gerekli bilgi birikimine sahip çalışanları olmadığını düşünerek, en baştan 510(k) başvurusundan vazgeçmektedir.
Halbuki tüm 510(k) başvuru prosedürünü yardımımızla tamamlamanız hiç de zor değil. 510(k) başvuru sürecinde nasıl destek olacağımızın adım adım hikayesini aşağıda bulabilirsiniz:
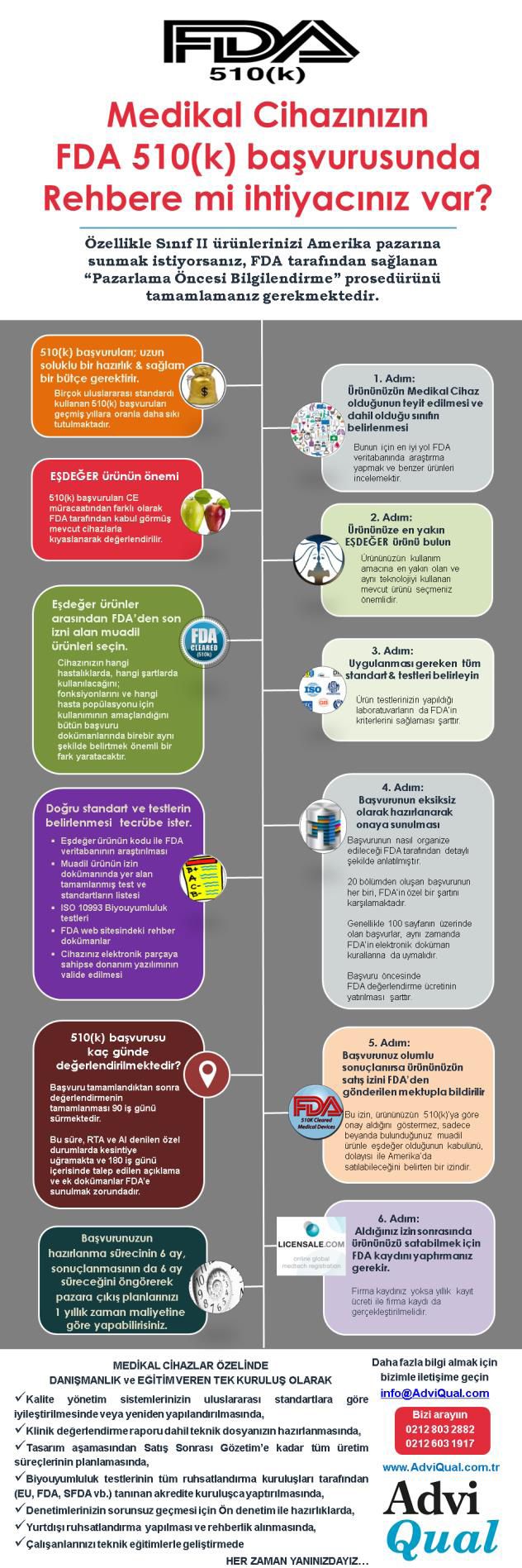
- FDA başvurusu bir yatırımdır bu nedenle bu yatırımın geri dönüşünü artırmak adına en güvendiğiniz ürününüzü seçip hazırlıkları ona göre yapmalıyız.
- 510(k) başvuruları her tıbbi cihaz için ayrı bir rehberlik ve farklı standartları sağlamayı gerektirir. Bu nedenle sizin ürününüzün hangi ürün kategorisine girdiğini belirlememiz için ürününüzün temel bilgileri olan kullanım amacı, kullanım alanı ve tasarımı/içeriği hakkındaki bilgileri sizlerden alıp analiz ederiz.
- Başvurular değerlendirilirken FDA daha önce benzer kullanım amaçlarında onay almış olan ürünlerle sizin ürününüzü karşılaştıracaktır. Bu nedenle sizin başvuru yapacağınız ürüne, FDA onayı almış en yakın eşdeğer ürünü belirlememiz ve ona göre dosyanızı hazırlamamız başvurunuzun en önemli adımlarından biridir.(Eğer danışmanımız ürününüzün FDA tarafından onay almış eşdeğer ürünlere göre yetersiz olduğunu düşünürse, sizinle beraber yatırım riskinizi azaltmak için 510(k) Ön onayı prosedürünü başlatmayı değerlendiririz.)
- Daha sonra ürününüzün bulunduğu kategori bazında özel olarak belirlenen gerekli dokümanların listesini, bu dokümanları bizlere iletmeniz için sizlerle paylaşırız.
- Sizden alınan tüm bilgi ve belgeler, İş ortağımızın Amerika’daki yerleşik 510(k) başvurularında uzman olan danışmanı tarafından incelendikten sonra, varsa eksiklerinizi tamamlamanız için size bildiririz.
- Tam bu adımda eksikliği ortaya çıkan ama firma kaynakları ile tamamlayamayacağınızı düşündüğünüz dokümanlar için AdviQual’in servisleri devreye girer ve eksiklerinizi tamamlamanızda uzmanlarımızın tecrübeleri ile doküman hazırlığı başarılı şekilde tamamlanana kadar yanınızda oluruz.
- Tüm dokümanlarınızı hazırlamamızın ardından 510(k) başvuru dosyanızın içeriği oluşturulmaya başlanır.
- İlk olarak seçilen eşdeğer ürün ile sizin ürününüzün teknik karşılaştırılması yapılarak diğer ürüne birebir benzediğinin kanıtları rapor olarak hazırlanır
- Farklı bölümlerden oluşan 510(k) başvuru dosyası, bize ilettiğiniz dokümanlarla oluşturulur.
- Başvuru öncesinde FDA’in kontrol yapmak için talep ettiği ücret ürüne göre belirlenerek, size bildirilir ve ödemeniz koordine edilir.
- Başvuru dosyaları ödeme makbuzu ile FDA sistemine hazırlanan dokümanların dijital kopyaları kayıt edilir. FDA ile bu aşamadan sonraki tüm yazışmalar sizin adınıza yürütülür.
- FDA’in ek bilgi talep etmesi durumunda istenen belgelerin detayları ve nasıl hazırlanması gerektiği konusunda sizlere bilgi verilir.
FDA’ya yapılan yıllık ortalama başvuru sayısı 2.500‘e yakındır ve doğal olarak bu başvuruların tümü satış izni alamamaktadır. Bu nedenle 510(k) başvurularının FDA tarafından onaylanma olasılığını artırmak için beraber çalışacağınız danışmanların tecrübeleri dikkat etmeniz gereken önemli bir konudur.
Bülteni indirmek için tıklayınız.
Tüm hakları AdviQual de saklıdır.
Kopyalanarak kullanılması durumunda firmamız referans gösterilmelidir.