Temel (Basic) UDI-DI
Temel UDI-DI numarası; aynı kullanım amacı, risk sınıfı ve temel tasarıma sahip cihazları veri tabanında bağlamak için kullanılan numaradır.
- Bu seri numarası etiketlerde kullanılmaz.
- Teknik dokümantasyonda ve EUDAMED’de kullanılması gerekmektedir.
UDI-DI numarası ile ilişki kurulması gereken dokümanlar aşağıdaki gibidir:
- Uygunluk deklarasyonu
- Serbest Satış Sertifikaları
- SSCP (Güvenlilik ve Klinik Performans Özeti)
- PMS (Piyasaya Arz Sonrası Gözetim) Raporu / PSUR (Periyodik Güvenlilik Güncelleme Raporu)
- Üretici Vaka Bildirimi (Manufacturer Incident Reporting - MIR)
- Trend Raporları
- Periyodik Özet Raporları
- Satış sonrası için klinik araştırma formları
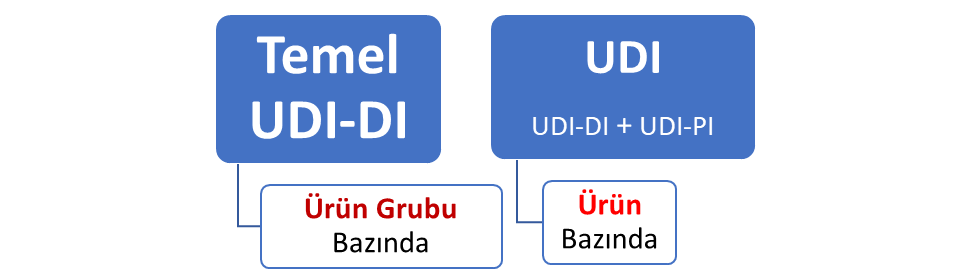
UDI
Ürün izlenebilirliğini sağlamak için kullanılan UDI kodu ise UDI-DI ve UDI- PI olmak üzere iki kısımdan oluşmaktadır.

UDI-DI statik olan değişmeyen bölüm olup, UDI-PI kısmı ise üretim kontrollerine ait bölümdür ve son kullanma tarihi, lot, seri no, üretim tarihi, içerik bilgisi gibi bilgilerle sürekli değişen, dinamik bir içeriğe sahiptir.
Hem ürün için hem de üründe kullanılan tüm ambalaj basamakları için bir UDI sistemine ihtiyaç duyulmaktadır.
(a) GS1 AISBL
(b) Health Industry Business Communications Council (HIBCC)
(c) ICCBBA
(d) Informationsstelle für Arzneispezialitäten — IFA GmbH
UDI-DI sisteminizi kurarken ülkemizde en çok kullanılan servis sağlayıcısı GS1 Türkiye'den hizmet alabilirsiniz. UDI-DI'ın temini için izlenmesi gereken adımlara GS1’in videolu açıklamasından ulaşabilirsiniz.
Barkod sisteminin Valide edilmesi gerekir mi?
Barkodlama sisteminin kurulduktan sonra valide edilmeyi gerektiren bir proses olması da önemli bir unsurdur.
Hangi değişimler için yeni GTIN atanması gerekir?
GS1’in yayınladığı “GS1 Healthcare GTIN Allocation Rules Standard” dokümanında detaylı cevap verilmiştir.
Miras Cihazlar (Legacy Devices) ve Temel (Basic) UDI-DI
MDR Madde 120(3) uyarınca, MDR'nin uygulama tarihinden (DoA – Date of Application) sonra ve belirli koşulların yerine getirilmesi halinde 26 Mayıs 2024'e kadar piyasaya sürülebilen tıbbi cihazlar eski (legacy) cihaz olarak adlandırılmaktadır. Bu kapsamda aşağıdaki cihazlar bulunur:
- 26 Mayıs 2021'den önce bir AT uygunluk beyanı düzenlenen ve MDR kapsamında uygunluk değerlendirme prosedürünün bir onaylanmış kuruluşun katılımını gerektirdiği 93/42/AET (MDD) Direktifi kapsamındaki Sınıf I cihazlar;
- 26 Mayıs 2021'den önce 90/385/AET (AIMDD) Direktifi veya 93/42/AET MDD uyarınca düzenlenmiş geçerli bir CE sertifikası kapsamındaki cihazlar.
Miras (legacy) cihazlar için Temel UDI-DI uygulanamaz ve hiçbir zaman eski bir cihaza atanamaz. Detaylı bilgi MDCG 2019-5 kılavuzunda bulunmaktadır.
EUDAMED'e kaydedilecek miras cihazlar için, EUDAMED’in işletilebilmesi adına Temel UDI-DI ve UDI-DI yerine başka iki benzersiz erişim anahtarı (ID) gereklidir.
Bu amaçla, Temel UDI-DI yerine cihaza bir EUDAMED DI atanacak, sistemin çalışmasına ve EUDAMED tasarımını MDR tasarımına mümkün olduğunca yakın tutmaya imkân tanımak için EUDAMED tarafından UDI-DI yerine bir EUDAMED ID atanacaktır. EUDAMED DI ve EUDAMED ID, bu miras cihaz için benzersiz olacaktır.
EUDAMED modül olarak parçalı bir şekilde devreye girecektir. Şimdilik ürün kayıtları gönüllülük esasına dayalı olarak yapılmaya başlanmıştır. Zorunlu hale getirildiğinde bilgilendirmeler yapılacaktır, takipte kalın.
Bu konudaki seminerimizin kaydını buradan izleyebilirsiniz
Kaynak: Management of Legacy Devices MDR EUDAMED – European Commission