Medikal cihaz üretiminde RİSK YÖNETİMİ
Günlük hayatımızda yer alan birçok araç, malzeme ve eşyayı; sundukları faydaların yanında beraberinde getirdikleri zararlar ve riskleriyle birlikte kullanmaktayız. Arabalar, cep telefonları, çamaşır suyu, hatta ekmek bıçağı, pil bunlara en basit örnekler olup, özellikle hatalı kullanımlarında bize ve çevremize ciddi zarar verebilirler. Tıbbi cihazların da benzer şekilde hatalı kullanımı hastaya ve/veya kullanıcıya zarar verebilir; hatta bu cihazların doğru kullanımı dahi bazı yan etki veya zararları beraberinde getirmesine rağmen sağlayacakları fayda daha fazla olacağından kullanılmaları son derece doğaldır. Önemli olan, tıbbi cihazların taşıdığı bu riskleri doktor, hasta, hastane, denetleyici ve resmi kurumlara doğru şekilde anlatmak ve olabildiğince azaltmaya çalışmaktır.
Medikal Cihazlarda ürünün geliştirilmesi, üretilmesi, stokta tutulması, onarımı ve imhasını içeren tüm yaşam döngülerinde iyi uygulanmış bir Risk Yönetimi uygulaması; üreticiye, risklerin belirlenmesini, değerlendirilmesini, gerekli kontrol ve önlemlerin alınmasını sağlar. Bu amaçla hazırlanan Risk Analiz Dokümanı hem tüm paydaşları cihazın kullanımı sırasında doğabilecek olası risklerden haberdar etmiş olur, hem de ürününün geliştirilmesi için fırsatları ortaya çıkarır. Dahası üreticilerin, cihazlarına ilişkin risklerin belirlenmesi, analiz edilmesi sonucu olabildiğince bertaraf veya kontrol edilmesini amaçlayan Risk Yönetim dokümantasyonu hazırlamaları bir yükümlülüktür.
Risk Yönetimi hakkında en çok başvurulan dokümanlar, bir risk yönetimi dosyasının gerekli içeriğini belirleyen ISO 14971 ve GHTF/SG3/N15R8 belgeleridir. Buradaki yönergelere göre Risk Yönetimi; tıbbi cihazlardaki risklerin analizi, değerlendirilmesi, kontrolü ve takibi ile ilgili prosedürlerin ve pratiklerin sistematik bir şekilde önce planlanıp daha sonra da bu plan doğrultusunda yürütüldüğü kritik bir faaliyettir.
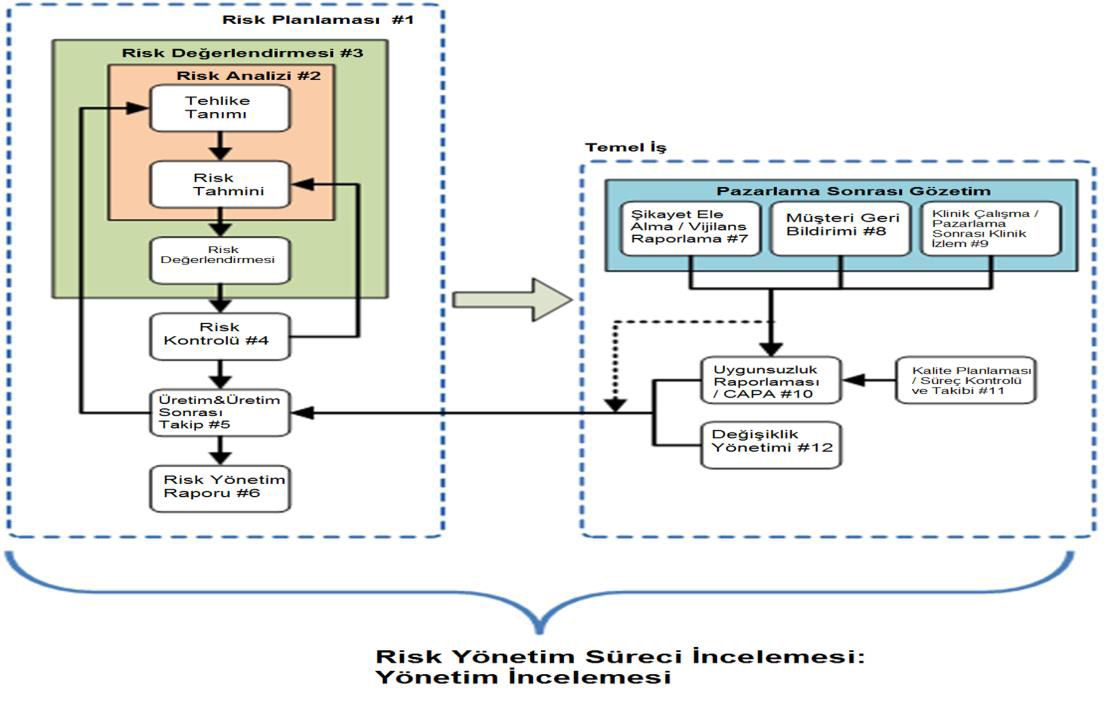
Risk Yönetim Planı: ISO 14971; söz konusu cihazı ve kullanım amacını tarif eden, yapılacak çalışmaların kapsamını bütüncül bir yaklaşım içerisinde organize eden, tüm sorumlulukları belirleyen, kabul edilebilir risk kriterlerini netleştiren, sürecin tarafsız şekilde işlemesini sağlayacak kuralları belirleyecek ve önemli konuların atlanmasını engelleyecek bir yol haritasını oluşturacak “Risk Yönetim Planı” oluşturulmasını gerektirmektedir. Bu plan, üreticinin kabul
edilebilir ve kabul edilemez risklerinin belirlenmesine ve risklerin nasıl ele alınacağına dair gerekli olan prosedürler için bir temel oluşturacaktır.
Risk: ISO 14971 çerçevesinde risk; bir tehlikenin veya zararın oluşma olasılığı ve ciddiyetinin kombinasyonu olarak tanımlanmıştır. Zarar; bireyin sağlığına, mülküne, veya çevresine verilen fiziksel hasar olarak tanımlanırken; tehlike ise zararın potansiyel kaynağı olarak görülmektedir. Risk seviyeleri karşılaştırmasında, nadir olarak görülebilecek zarar veya tehlikeli durumlar; çok daha sık görülebilecek orta seviyedeki zarar veya tehlikeli durumlardan daha az riskli olabilmektedir. Kabul edilebilir veya edilemez riskler tartılırken, cihazın fonksiyonel gerekliliklerinin göz önünde bulundurulması oldukça büyük bir önem arz etmektedir. Cihazın fonksiyonel ve güvenlik gerekliliklerinin önceden belirlenmesi; risk yönetim sürecinin cihaz yaşam döngüsü boyunca geriye dönük olarak izlenebilir olması ve kabul edilebilir ve edilemez risklerin önceden tanımlanmış seviyelerine uygun olarak mazur görülebilir olması açısından önemlidir. Risk yönetim planı aynı zamanda; planın tam anlamıyla gerçekleştirildiğini doğrulamak amacıyla üreticinin hayata geçirmesi gereken doğrulama faaliyetlerine de değinmektedir.
Risk Analizi: Her bir tıbbi cihaz için, farklı kapsamda yapılması gereken risk analizi, 3 ana parçadan oluşmaktadır;
1) cihazın tanımı, tarifi, sayısal özellikleri, kullanım amacının belirlenmesi,
2) cihazın normal ve hatalı kullanım durumlarına göre değişen öngörülebilir tehlikelerin ve oluşma şartlarının tariflenmesi,
3) Her bir tehlike durumunun neden olacağı zararların olasılık ve risk derecelerinin belirlenmesi.
Risk analizini yapan ekip; ürünün yaşam döngüsü içindeki tüm olası riskleri tanımlayıp, tanımlanan her bir risk için de risk tahmini yapar. Risk, bir tehlikenin ciddiyeti ve ortaya çıkma olasılığı olarak tanımlandığından dolayı; risk tahmini çoğunlukla risk seviyesine ve bunun gerçekleşme olasılığından oluşan nicel bir değerlendirme üzerinden yapılmaktadır. Böylece öncelik verilecek ciddi riskler ortaya çıkartılır.
Risk Analizi; muadil ürünlere ait geçmiş risk analizlerinden de faydalanılarak, analizi gerçekleştiren kişi ve kurumları, analizin kapsamını ve tekrar gözden geçirme kriterlerini belirleyen ve tüm bulguların Risk Yönetim Dokümanı içinde kayıt altına alınan bir süreçtir.
Risk Ölçümleme: Öngörülen tehlikeli durumların neden olacağı risklerin giderilmesi / azaltılması gerekip gerekmediği kararının, Risk Yönetim Planında belirlenen kriterler doğrultusunda verildiği süreçtir. Bu sürecin çıktıları da yine Risk Yönetim Dokümanı altında kayıt edilmelidir.
Risk Kontrolü: Hedefte, tıbbi cihazların üretilirken risklerden arındırılması olsa da, bu çoğu zaman mümkün olmamaktadır. Bu durumda risklerin bertaraf edilmesi veya azaltılması için üreticiler kontrol yöntemleri tasarlamalıdır. Risk kontrolü; her biri risk yönetim dosyasında belirtilmesi gereken aşağıdaki aksiyonlardan oluşan kritik bir adımdır:
a) Risk kontrol seçeneklerinin analizi: Bu adımda, risklerin kabul edilebilir seviyeye çekilmesi için uyulacak kriterler belirlenir ve uygulanacak yöntemleri içerir. Bu yöntemler, tasarımda güvenliğin kendiliğinden sağlanması; olamıyorsa bariyerler uyarıcılar ve alarmlar kurgulayarak,entegre önlemler alınması, bunun da mümkünolmadığı durumda kullanım kılavuzu ve etiketleme yoluyla güvenlik bilgilerinin kullanıcılara sağlanması olarak tanımlanabilir.
b) Risk kontrolünün uygulanması: Seçilen Risk Kontrol yönteminin gerçekten uygulandığı ve işe yaradığının doğrulanmasını içeren kayıtların hazırlanmasıdır.
c) Kalan risklerin değerlendirilmesi: Kalan risk, risk kontrol yöntemlerinin uygulanmasından sonra geriye kalan risk olarak tanımlanmaktadır. Diğer bir deyişle, risk kontrolünün uygulanmasından sonra geriye kalan her riskin risk yönetim sürecine tekrar yedirilmesi ve risk seviyesi, olasılık ve kabul edilebilirlik bağlamında tekrar değerlendirilmesi gerekmektedir.
d) Risk/Fayda analizi: Risk kontrol adımları ile azaltılamayan risklerin kabul edilebilir seviyelere gelmemesi durumunda, üretici literatür ve verilerden yararlanarak ürünün sağladığı faydanın riske göre daha ağır bastığını kabul ederek kullanıcı ve hastaları bilgilendirici önlemler alacak şekilde risk kontrolünü tamamlayabilir.
Üretim ve üretim sonrası bilgiler: İlave risklerin belirlenmesi adına ürünün pazar sonrası bilgilerinin izlenmesini içermektedir. Öngörülemeyen yeni risklerin tanımlanması ya da kalan risklerin ciddiyetinin yeniden değerlendirilmesi adına üretici tarafından bu bilgilerin nasıl toplanacağına dair bir plan hazırlanmalıdır. Bu plan, bilgilerin toplanması, incelenmesi ve piyasada var olan diğer eş değer cihazlarla karşılaştırılmasını içermektedir. Eğer yeni bir riskle karşılaşılırsa; bu risk, risk yönetim dokümanına tahmin, analiz ve kontrol açısından dahil edilir.
Üretim ve sonrasında tıbbi cihazların takip edilerek veri toplanmasını ve bunların tekrar değerlendirilmesini sağlayacak bir sistemin kurularak, toplanan bulguların dokümante edilme aşamasıdır. Bu adımda karşılaşılan yeni riskler; tahmin, analiz ve kontrol açısından risk yönetimine dahil edilir.
Bülteni indirmek için tıklayın.
Tüm hakları AdviQual de saklıdır.
Kopyalanarak kullanılması durumunda firmamız referans gösterilmelidir.



