İş ortaklarımızdan Custom Medical’in hazırladığı içeriği temeli alan bu bülten MDR sonrası birçok üreticimizin tanıştığı Kullanılabilirlik Mühendisliği kavramı ve ilgili standardı IEC 62366-1 üzerine hazırlanmıştır.
Bir zorunluluk olarak Kullanılabilirlik Mühendisliği
Tıbbi cihazlarınızın satış izni almasında azımsanmayacak bir ağırlığı olan Kullanılabilirlik Mühendisliği ve Testleri ile ilgili kendi süreçlerinizi ve durumunuzu değerlendirmeniz ve sınıflandırmanız için ilgili mevzuat gereklilikleri üzerinden kısaca geçmek istiyoruz.
Firmalarda genellikle aşağıdaki durumları gözlemlemekteyiz:
- Resmi bir Kullanılabilirlik Mühendisliği süreci olmadan gayri resmi ilerletme
- Çok az deneyime sahip olunan bir alanda yeni bir geliştirme yapılırken henüz netleşmeyen kullanılabilirlik gereksinimleri veya planlanması, yürütülmesi ve değerlendirilmesi gereken geliştirici çalışmaların (formative studies) artması
- Tıbbi cihaz tamamlanmış olsa da Avrupa veya Amerika pazarına kabul için sonuç değerlendirmelerin (summative evaluations) olmayışı
- MDD kapsamında onaylanmış cihazın MDR geçiş çalışmalarında veya geliştirme yapılması icap eden cihazın teknik dosya için Kullanılabilirlik Dosyasının nasıl hazırlanacağının bilinmemesi
Kullanılabilirlik önem kazanıyor
Tıbbi cihazlar için Kullanılabilirlik Mühendisliğinin 2006 yılından bu yana kendi standardı olmasına rağmen geliştirme ve dokümantasyon alanlarında uygulamadaki önemi sınırlı kaldı. Özellikle 2015 yılında standardın tamamen revize edilmesinden sonra hem üreticilerden hem de onaylanmış kuruluşlardan yeterince ilgi görmedi. MDR ve IVDR'nin yürürlüğe girmesiyle birlikte mevzuata ilişkin ani ve büyük değişiklikler yapıldı.
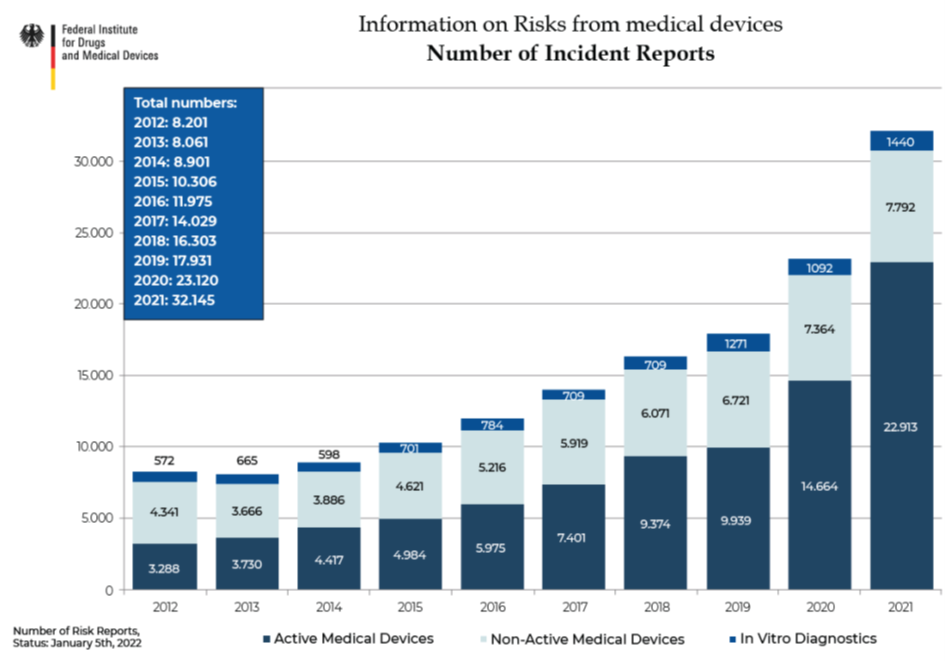
Grafik kaynağı:
https://www.bfarm.de/DE/Aktuelles/Statistiken/Medizinprodukte/_node.html (03.06.2022 itibariyle)
Her ne kadar o zaman Kullanılabilirlik kelimesi MDR'de (yalnızca ekinde) iki kez geçse de Kullanılabilirliğin geliştirme ve temizleme sürecinin önemli bir parçası olduğu artık açıktır. MDR'nin en az 10 yerinde, ister ürünün kendisi için isterse beraberindeki dokümantasyon veya etiketleme için olsun, Kullanılabilirlik Mühendisliği için gereklilikler bulunmaktadır.
- Almanya'da 2012 yılında risk raporlarının sayısı toplam 7.500 civarındayken, 2021 yılı sonunda özellikle Aktif tıbbi cihazlar için 7 kat artarak 22.913'e ulaşması
- 2017 verilerine ait kök neden analizlerinde (daha yeni veriler mevcut değildir), yaklaşık 13.000 raporun neredeyse 3.500'ünde yetersiz parça kullanımı, yetersiz eğitim veya talimat veya hatalı uygulama gibi Kullanılabilirlik ile çözülebilecek risklerin tespiti,
- özellikle de ameliyat odalarındaki vakalarda hastalara verilen zararın uzun ameliyat süreleri, yoğun bakım veya ölümle sonuçlanabilecek ciddi sonuçları olması (Çalışmanın kaynağı: Montag, K. (2012). Investigation of the Usability of medical devices in the operating room.Dissertation at the Medical Faculty of the Eberhard Karls University of Tübingen.)
getirilen kuralların gereksiz olmadığının bir göstergesidir.
Bir üretici olarak sizin için sonuçlar
Kullanılabilirliğin tıbbi cihazların tasarımı ve üretiminde yer almasının, cihazların güvenli kullanımı üzerinde önemli bir etkisi olduğunun giderek daha fazla farkına varılması, genel güvenlilik ve performans gereklilikleri için MDR’nin üreticilerden geçmişte olduğundan çok daha fazla Kullanılabilirlik çalışması talep etmesine neden olmuştur. Bu bağlamda Kullanılabilirlik Dosyasındaki belgelerinizde yer alması gereken ana hususlardan bazıları şöyledir:
♦ Amaçlanan kullanımdan ve öngörülebilir yanlış kullanımdan kaynaklanan risklerin ölçülmesi ve değerlendirilmesi.
♦ Kullanım hatalarından kaynaklanan risklerin hariç tutulması ve azaltılması amacıyla:
♦Ürünün ve çevrenin ergonomik özelliklerinin iyileştirilmesi
♦ Kullanıcıların teknik bilgi, deneyim, eğitim ve öğretim, kullanım ortamı, sağlık ve fiziksel durumunun incelenmesi.
Kullanılabilirlik Dosyanızın bulunmaması, var olan kullanılabilirlik dosyanızda kısa süreli UOUP Sürecinin seçilmesi için sunulan gerekçenin, Özet Değerlendirmenin veya hatalı uygulanmalara yönelik eksiklikler nedeniyle uygunsuzluk raporu düzenlenmesi bir yana özellikle Avrupa ve Amerika’daki cihazla ilgili olumsuz olaylarda, üretici olarak kusurlu cihaz üretmekten dolayı tüm sorumluluğu size çıkartılabilir.
Kullanılabilirlik Mühendisliği ve testleri konusunda; tıbbi cihazların kullanıcı arayüzü tasarımı, çalışma katılımcılarının işe alınması ve geliştirici ve sonuç değerlendirmelerinin (formative and summative evaluations) hazırlanması konularında yetkin çalışanınız yoksa uzman kullanımı güvenli bir yol olacaktır.
Vaka Çalışması:
Yara bakımı alanında faaliyet gösteren büyük bir üreticiye MDR geçişi için sağladığımız hizmeri bir vaka çalışması olarak ele alarak çalışmalarınızı planlamanızda yardımcı olmayı umduk.
Üreticinin ilk durumu:
♦Ürünlerin çoğunluğu hem MDD hem de MDR kapsamında sınıf I ürünlerdi, ancak daha yüksek risk sınıflarında ürünler de vardı,
♦Yerleşik bir Kullanılabilirlik Mühendisliği süreci yoktu,
♦ Mevcut Kullanılabilirlik Dosyası yoktu,
♦ İyi piyasa sonrası gözetim verileri vardı,
♦Daha önce çok az deneyimi olan yeni bir Kullanılabilirlik Mühendisliği ekibi bulunuyordu.
Bu üretici için uyguladığımız 5 adımlı planımız şöyleydi:
1. Boşluk Analizi: Dahili süreçler ve şablonlar dahil olmak üzere mevcut tüm Kullanılabilirlik Mühendisliği dokümantasyonlarının gözden geçirildi; yasal gerekliliklerle karşılaştırıldı; boşluklar ve sapmalar belirlendi.
2. Kullanılabilirlik Mühendisliği sürecinin oluşturulması: Hem mevzuata uygunluğu hem de sürecin şirkette pragmatik bir şekilde uygulanmasını sağlamak için şirketteki temel paydaşlarla işbirliğine dayalı süreç geliştirildi.
3. Şablonların ve dokümantasyon formlarının geliştirilmesi: Şirketin dahili ve bireysel Kullanılabilirlik Mühendisliği süreci temel alınarak, dahili ekibin gelecekte çalışabileceği şablonlar ve dokümantasyon formları oluşturuldu.
4. İlk dokümantasyonun hazırlanması: Yeni şablonlara, pazar sonrası gözetim verilerine ve diğer ön çalışmalara dayanarak, ürünler için Kullanılabilirlik Mühendisliği Dosyaları oluşturuldu. Özetleyici değerlendirmeler (formative evaluations) planlandı ve gerektiğinde eşlik edildi.
5. Ekibin etkinleştirilmesi: Şirketin dahili yetkinliklerini güçlendirmek için ekip, tıbbi cihazlar için Kullanılabilirlik Mühendisliği konusunda eğitim alırken çalışma planları ve üretilen belgeler hakkında sürekli geri bildirim sağlandı.
Vaka Çalışması: Yetersiz metodoloji ile tamamlanmış çalışma
FDA başvurusu yapmış, uluslararası faaliyet gösteren dental implant üreticisi firmamızın hazırladığı kullanılabilirlik dosyası, yapılan incelemede FDA'nın beklentilerini karşılamadığını gösterdi.
İlk durum:
♦ Tıbbi cihaz tamamen geliştirilmişti ve sadece satış izni için beklemekteydi,
♦ Sonuç Değerlendirme (summative evaluation) Kullanılabilirlik Çalışması harici bir danışman ile yürütülmüştü,
♦ İnsan faktörleri mühendisliği dokümantasyonu FDA tarafından yetersiz bulunmuştu.
Bu üretici için uyguladığımı 5 adımlı planımız şöyleydi:
1. FDA-Geri Bildiriminin Gözden Geçirilmesi: Müşteri ile birlikte FDA'nın başvuruya ilişkin geri bildirimler gözden geçirildi ve geçmiş toplantılar özetlendi.
2. Boşluk analizi ve mevcut sonuçların kısmi kullanımı için bir gerekçe geliştirilmesi: Çalışma tasarımı kusurları belirlenerek ruhsatlandırmada tekrar kullanabileceğimiz çalışma sonuçları seçildi.
3. Çalışma planı revizyonu ve ön görüşme: FDA'nın geri bildirimlerine dayanarak yeni bir çalışma planı oluşturuldu ve FDA ile yapılan ön görüşmede tekrar kullanılabilecek sonuçların seçilmesine ilişkin gerekçeler sunularak geri bildirim alındı.
4. Yeni sonuç çalışmasının (summative study) planlanması, yürütülmesi ve değerlendirilmesi: Koordine ettiğimiz yeni çalışma planına göre sonuç çalışması (summative study) yürütüldü.
5. Revize edilmiş bir İnsan Faktörleri Validasyon Raporu oluşturulması: Uygun yerlerde ilk çalışmanın sonuçları da kullanılarak yeni çalışmanın sonuçlarına göre İnsan Faktörleri Validasyon Raporu hazırlandı.

Kullanılabilirlik Mühendisliği Pratik Uygulamaları
Kullanılabilirlik Mühendisliğindeki faaliyetler birçok üretici için temelde benzer olsa da cihazlar ürünler, hedef gruplar, kullanım amaçları ve riskler farklılaştıkça önemli değişiklikler göstermektedir. Bu nedenle, bir Kullanılabilirlik Mühendisliği sürecinin uygulanması ve ilgili belgelerin oluşturulması özellikle iki madde hayatiir:
1. Gereksinimlerin anlaşılması ve
2. Tecrübe ile kullanılabililik şartlarının pratik olarak uygulanması ve cihaz üreticisi olarak süreçlarinizin en ekonomik şekilde hayata geçirilmesi.
Cihaz sayısının azlığı nedeniyle; Kullanılabilirlik veya klinik dokümanları hazırlamak gibi özel uzmanlık gerektiren kimi rollerin verimli şekilde kullanılmaması çoğu üreticiyi firmasında istihdam için uzman aramak yerine danışmanlık almaya yönlendirmektedir. Bunun başka bir sebebi de tüm faaliyetleri uygun düzeyde kendi başına gerçekleştirebilecek, yeterli deneyime sahip çalışanların çok az sayıda olmasıdır.
Yeni bir ürün geliştirmek, mevcut bir ürünü iyileştirmek, testlerini tasarlamak ya da yasal gerekliliklere uygun dokümantasyon hazırlanması konusunda birçok firma, en az bir çalışanı; asıl işinin yanında cihazların kullanılabilirlik konularından tamamen sorumlu olacağı şekilde şirket içinde görevlendirerek, gerekli tüm görevleri tamamlayabilmesi için alınacak dış desteği koordine edip, yönetmesini sağlayarak çözüm bulmuştur.
Eğer bizden danışmanlık almak isterseniz önce talebinizi netleştirmek ve mevcut durumunuzu anlamak için toplanırız. Size sunacağımız hizmetler için teklifimizi sunar kabul edilirse proje ile ilgili iletişim kanalları, proje içeriği, kullanılacak programlar ve koşulları belirleyerek başlangıç belgesine kaydederiz. Bundan sonra asıl çalışma başlar. Proje süresince haftalık olarak toplanarak birbirimize danışırız. Bu şekilde projenin tam olarak sizin istediğiniz gibi yürümesini ve her zaman iyi şekilde bilgilendirilmenizi sağlarız.
Kaynakça: Custom Medical, CM_Marketing_Bericht_Übersetzung_V001_mk pazarlama dokümanı