1. Ön değerlendirme
-
MDR’ın önemi ve ticari yansımalarının tam olarak kavranması için bilgilendirme yönetimi
-
Kuruluş zorluklarını dikkate alma: Yönetim farkındalığı, istihdam gücü, durumu, bütçe sonuçları
2. Boşluk analizi ve bundan kaynaklanan aksiyonlar
-
Ürünlere, iç kaynaklara, kuruma ve bütçeye etkisini değerlendirme
-
Yeni sınıflandırma kurallarının (MDR Sınıfları I, IIa, IIb ve III) kontrolü ve mevcut ve gelecekteki ürünlerin uygunluk değerlendirme rotasının teyit edilmesi
-
Tıbbi Cihazın (MD) yeni tanımının özellikle genişletilmiş kapsamı ile ilgili kontrolü. Bu Ek XVI kapsamındaki ürünler için de geçerlidir.
-
Mevcut teknik dokümantasyon için gerekli değişiklikleri gözden geçirme (Teknik Dosyalar)
-
Kalite Yönetim Sistemini (KYS) gözden geçirme ve iyileştirme (aşağıdaki 3. madde)
-
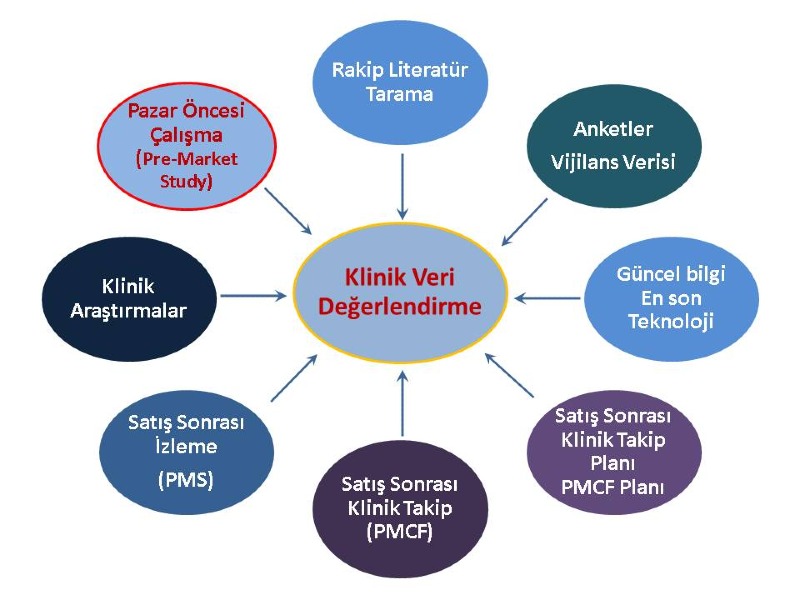
Eldeki klinik kanıt ve risk yönetiminin yeterliliğinin kontrolü ve boşlukların tespiti (Madde 61)
-
Ürün etiketlemesinin gözden geçirilmesi (Ek I Bölüm III)
-
Piyasaya arz sonrası gözetim düzenlemelerinin yeterli olduğunun garanti altına alınması (Kısım VII Bölüm 1)
-
Piyasaya arz sonrası klinik takip planı (PMCF, Ek XIV Kısım B) hazırlanması
-
Yeni vijilans gerekliliklerine hazır olma (Kısım VII Bölüm 2)
-
İzlenebilirlik yükümlülüklerinin sağlanması (Kısım III)
3. Kalite Yönetim Sistemi (KYS)
-
Yeni Regülasyon kapsamında tıbbi cihaz standart ve süreçlerini karşılamak üzere KYS yeterliliğinin gözden geçirilmesi
-
KYS’ye yeni mevzuat gereksinimlerin kurulması
-
Kurum içinde mevzuata uyumdan sorumlu kişinin istihdam edilmesi (Madde 15), bu kişinin yeterli niteliklere sahip ve eğitim almış olması
4. Tüzel Kişiler
-
Firmanın nasıl etkilendiğini netleştirme: tüzel kişiler, iktisadi işletmecilerin yükümlülüğü, organizasyonel yapı ve kaynaklar
-
Kuruluş sorunlarını dikkate alma: Yönetim farkındalığı, istihdam gücü ve durumu, bütçe sonuçları/yansımaları
-
Ürün sorumluluğu sigortasının yeterli olduğunu kesinleştirme
5. Portföy
-
Ürün portföyü için bir maliyet analizi yapılması; tıbbi cihazların (MD) risk sınıfının yükselme ihtimalinin, uygunluk değerlendirme için yeni prosedür maliyetlerinin yanı sıra piyasaya arz sonrası gözetim maliyetlerinin ve teknik dokümantasyondaki boşlukların göz önüne alınması ve buna göre MDR geçişinizin planlanması.
-
Tedarik zinciri hükümlerini gözden geçirme ve iş ortaklarının rol ve sorumluluklarını netleştirme (yetkili temsilciler, ithalatçılar, dağıtıcılar)
6. Temel uygulama planı
-
Uygulama için alt projelerin, kaynak gereksinimlerinin ve idare grubunun belirlenmesini kapsayan bir yol haritası oluşturma ve MDR uygulaması için genel sorumlulukların oluşturulması
-
Geçiş dönemini, geçiş şartlarını ve Onaylanmış Kuruluşların uygunluklarını aklınızda bulundurarak sertifikaların bitiş tarihlerine gereken önemin verilmesi
7. Onaylanmış Kuruluşlar
-
Seçilen Onaylanmış Kuruluşlarla temasa geçilmesi ve uygulama planına hizmet için kapasitelerinin ve uygunluklarının öğrenilmesi
8. Mevzuat eğitimi
-
MDR uygulaması ve geçiş seminerleriyle personelin eğitilmesi ve güçlendirilmesi
9. Temel uygulama planını yürütme
-
Çeşitli alt-projelerin (klinik değerlendirme, teknik dokümantasyon, diğer iktisadi işletmecilerle ilişki, Tekil Cihaz Tanımlama – UDI, etiketleme, kayıt, piyasaya arz sonrası gözetim, vijilans ve BT sistemleri raporlaması) yürütülmesi
-
Uygulamanın tüm yönlerini kapsayacak çapraz fonksiyonlu bir proje yönetim ekibi oluşturulmasını sağlama
-
MDR uygulaması için toplu ve bireysel sorumlulukların oluşturulması
10. Verimlilik ve etkinlik gözden geçirme
-
Projenin durumu ve ilerlemesi, fark ve boşluk analizleri, riskler, ileriki adımlar ve gerekliliker hakkında düzenli toplantıların yapılması
-
MDR uygulama planına karşı düzenli ilerleme incelemelerinin yapılması ve bunların yönetim gözden geçirme sürecine dahil edilmesi
11. Onaylanmış Kuruluş Bildirimi
-
Onay sürecindeki gecikmelerden kaçınmak için başvuru tarihlerini görüşme
12. Devam eden izleme
-
Hala gelişen Avrupa düzenleyici çevrenin ve önümüzdeki aylarda beklenen kılavuzların/yönergelerin aktif olarak izlenmesi (DG GROW tıbbi cihazlar web sayfalarını kontrol edin ve haber bültenlerine abone olun)
-
Onaylanmış Kuruluşların habersiz denetimlerini idare edebilmek için bir prosedür oluşturulması
-
MDR uygulama planını düzenli olarak gözden geçirme, önemli risk alanlarının tanımlanması ve karşılanması